Struktur/Eigenschaften Chemiezauber.de
Die van-der-Waals-Kräfte nehmen mit zunehmender Kettenlänge, also zunehmender Masse der Moleküle und zunehmender Berührungsfläche, zu.Das hat zur Folge, dass sich die Moleküle mit zunehmender van-der-Waals-Kraft untereinander immer stärker anziehen. Dies wiederum bedeutet, dass man mehr Energie zufügen muss (länger erwärmen muss), bis die Moleküle eine Geschwindigkeit erreichen, die.
Was sind VanderWaalsKräfte 01 Chemie Stoffeigenschaften und Teilchenmodell Repetico
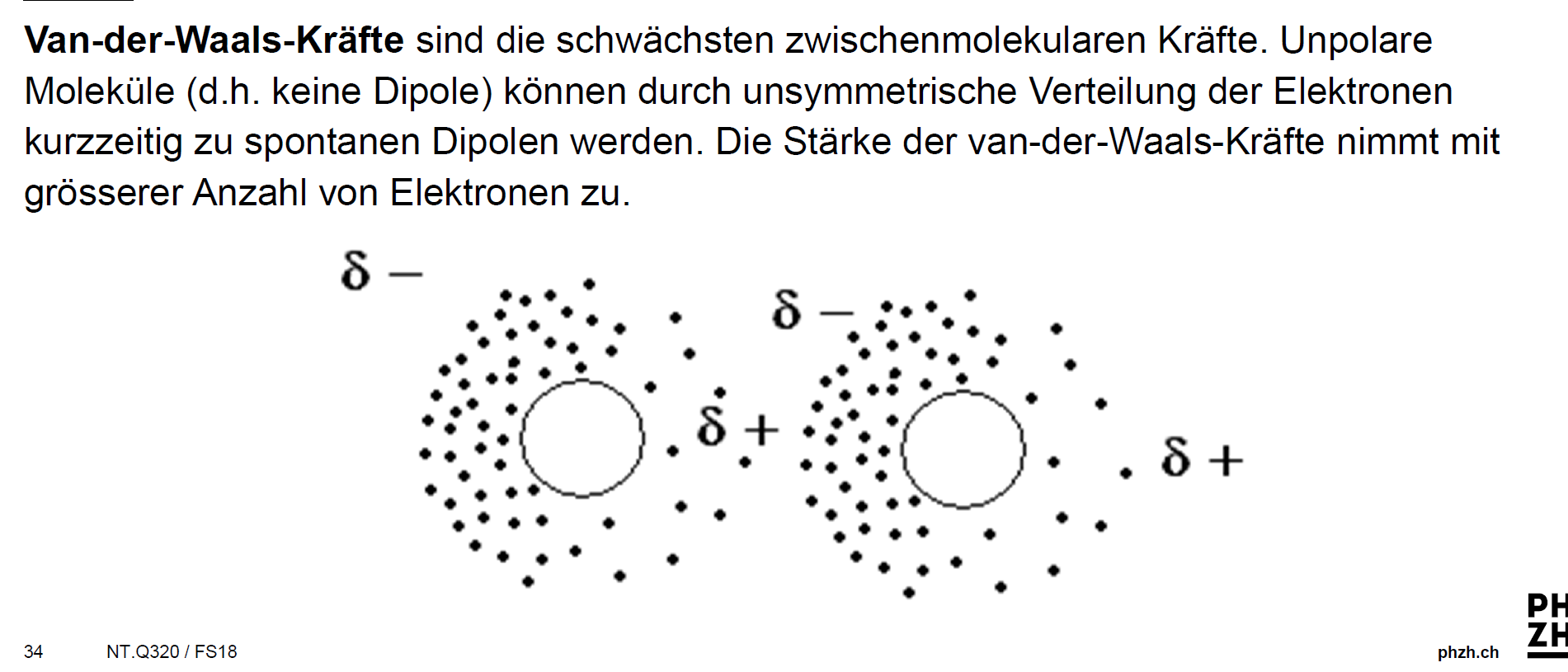
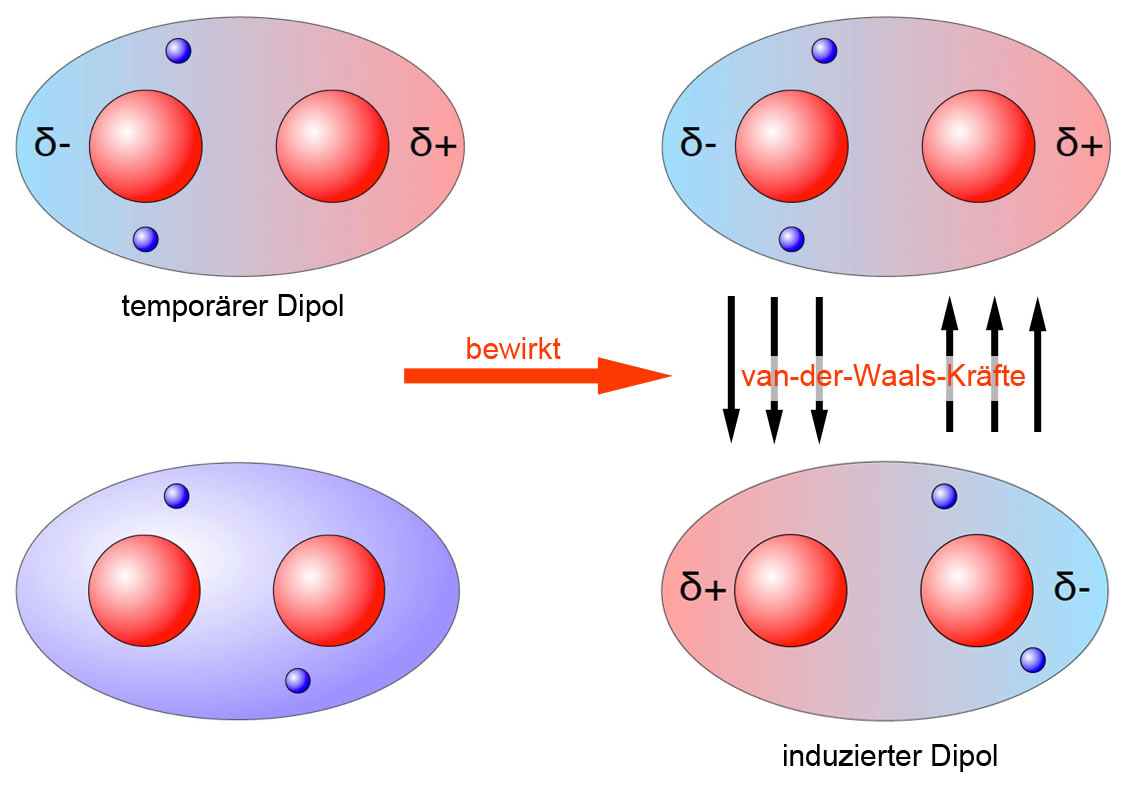
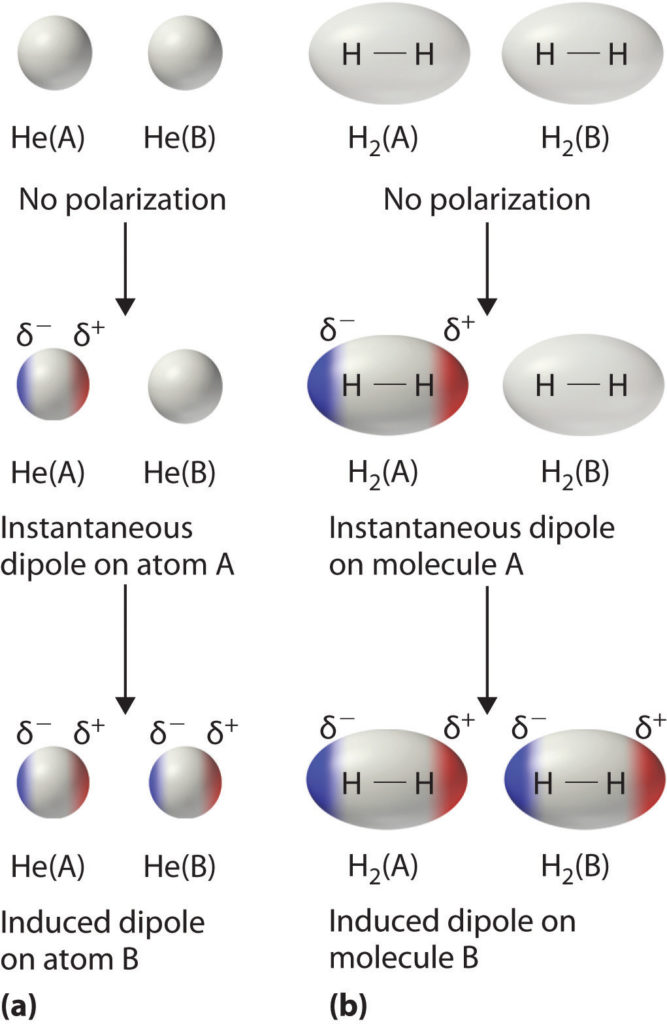
Aufgrund der kurzen Lebensdauer dieser Dipole bilden sich zwischen ihnen schwache Anziehungskräfte aus. Diese Kräfte heißen Van-der-Waals-Kräfte. Sie sind nach dem niederländischen Physiker Johannes D. van der Waals (1837-1923) benannt, der für die Entdeckung dieser Wechselwirkungen 1910 den Nobelpreis erhielt. Der Forscher erklärte.

VanderWaalsKräfte · Definition & Beispiel · [mit Video]
Van-der-Waals-Kräfte. Mit Van-der-Waals-Kräften, benannt nach dem niederländischen Physiker Johannes Diderik van der Waals (1837-1923), bezeichnet man die relativ schwachen nicht- kovalenten Wechselwirkungen zwischen Atomen oder Molekülen, deren Wechselwirkungsenergie mit etwa der sechsten (!) Potenz des Abstandes abfällt.

Was Sind Van Der Waals Kräfte
Vergleichen wir einmal die Siedepunkte der ersten vier Alkane mit den Siedepunkt der von diesen Alkanen abgeleiteten Chlor-Alkane. n Alkan Chlor-Alkan; 1: Methan: -161.6: Chlor-methan: -23,8: 2: Ethan: -88,6:. In den meisten Schulbüchern werden diese sehr schwachen intermolekularen Wechselwirkungen als van-der-Waals-Kräfte bezeichnet.

VanderWaalsKräfte SchulLV
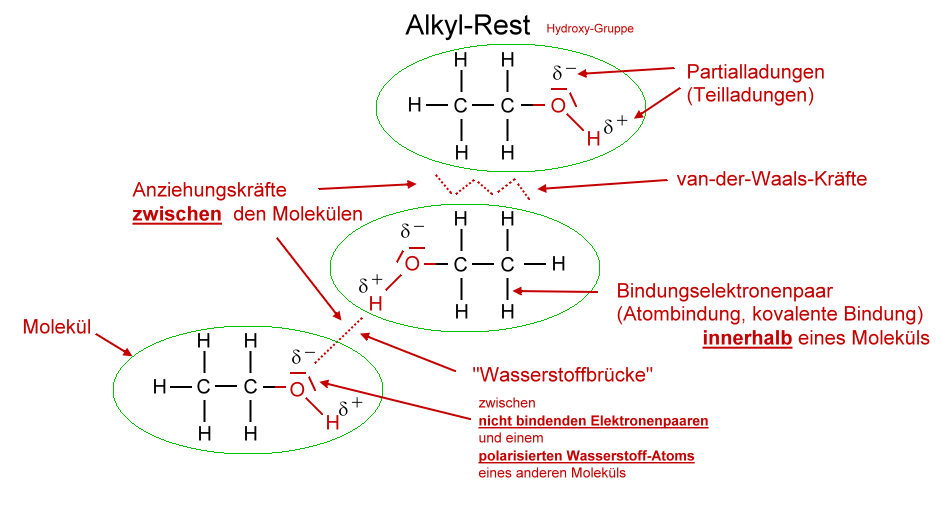
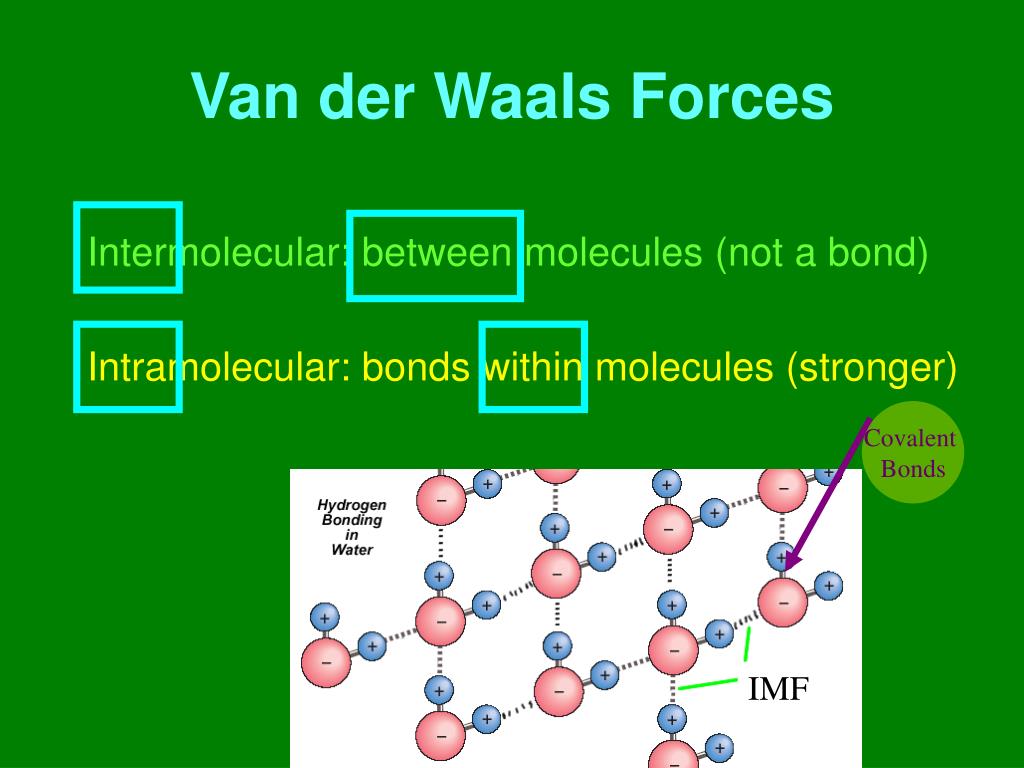
In der Chemie unterscheidet man zwei verschiedene Arten von Kräften: Die intermolekularen und die intramolekularen Kräfte. Intermolekulare Kräfte bzw. chemische Bindungen im engeren Sinne herrschen zwischen den verschiedenen Molekülen untereinander. Es gibt die Van-der-Waals-Krafte, die Dipol-Dipol-Wechselwirkungen, die Wasserstoffbrücken.
Elektronegativität
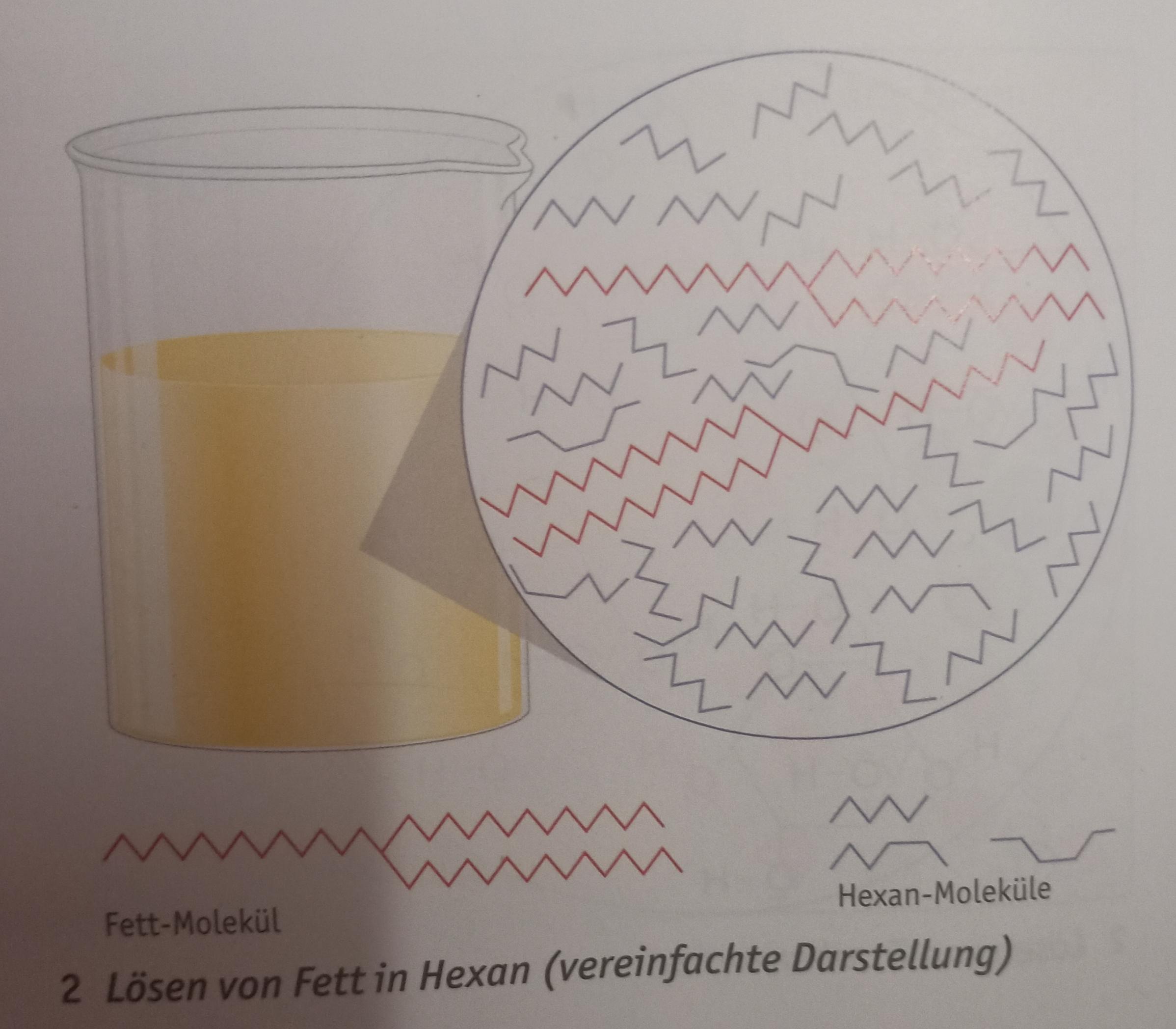
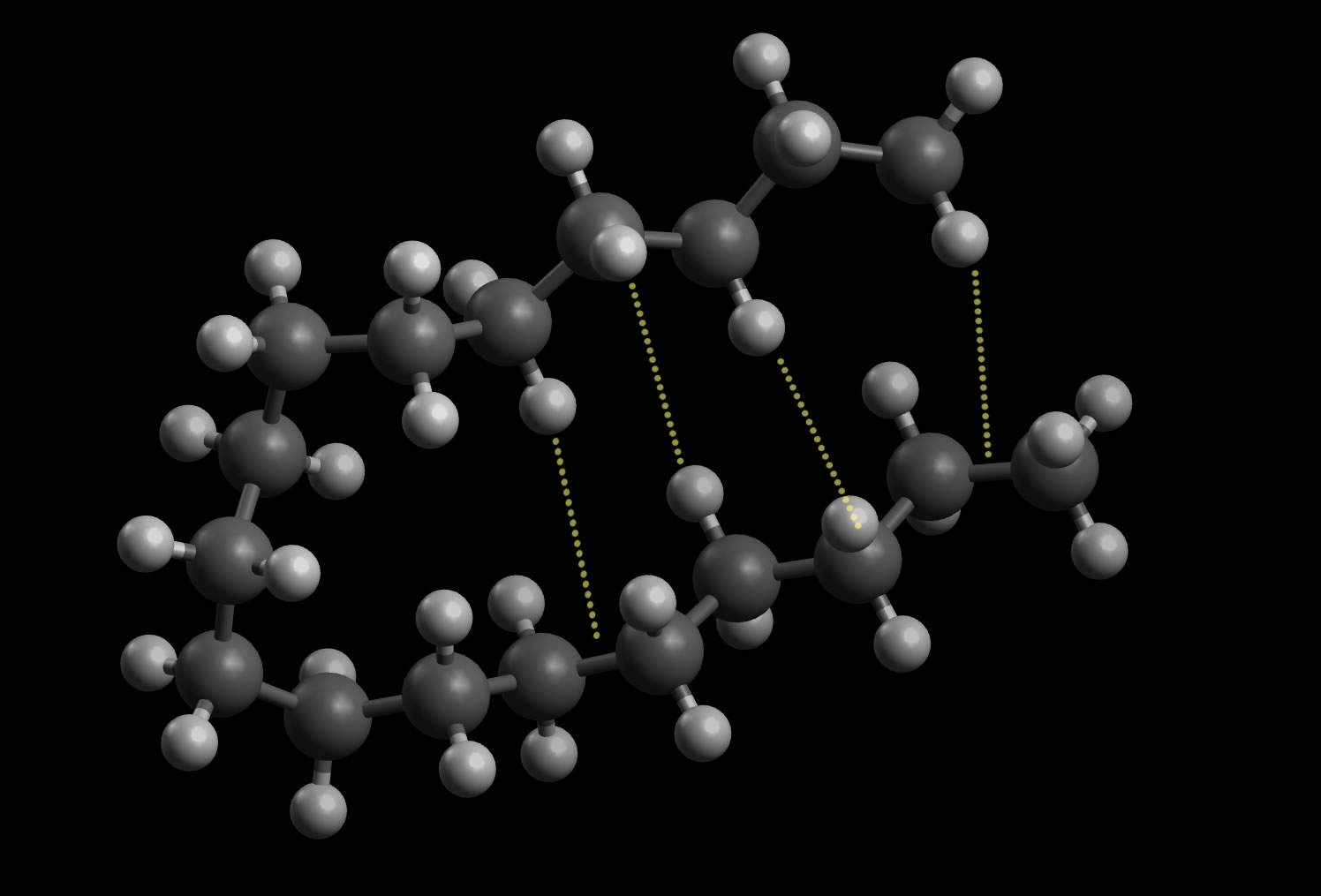
Die Alkane sind das bekannteste Beispiel für die van der Waals Kräfte. Alkane sind Kohlenwasserstoffe mit der allgemeinen Summenformel . Prominente Vertreter sind unter anderem Methan , Ethan oder Butan. Der Vergleich von kurz- und langkettigen Molekülen zeigt eine unterschiedliche Stärke der van der Waals Wechselwirkungen auf.

Van der waals kräfte? Chemie, Alkane, dipol)
Van-der-Waals-Kräfte Alle Moleküle, auch die unpolaren, üben Anziehungskräfte aufeinander aus. Diese bin-denden Kräfte nennt man Van-der-Waals-Kräfte (nach ihrem Entdecker, dem holländi-schen Physiker van der Waals, 1837-1923). Die Kräfte, mit denen sich die Moleküle gegenseitig anziehen, sind im Allgemeinen schwach.
Löslichkeiten von Fett (Van der Waals Kräfte?)? (Chemie, alkane, Löslichkeit)
Die Van-der-Waals-Kräfte bezeichnen die Anziehungskräfte zwischen den einzelnen Molekülen. Normalerweise sind die Anziehungskräfte eher schwach und haben eine geringe Reichweite, deshalb wirken sie nur an Stellen, an denen sich Moleküle sehr nah kommen. Wenn ein Molekül also größer ist, hat es eine größere Fläche, mit der es andere.
vanderWaalsKräfte
Der Einfluss der Van-der-Waals-Kräfte lässt sich am Beispiel der Alkane verdeutlichen: Mit zunehmender Kettenlänge nimmt der Siedepunkt zu. So hat Ethan zum Beispiel einen Siedepunkt von -88,6 °C, während n-Heptan einen Siedepunkt von 98,4 °C hat.

van der waals kräfte definition beispiel mit video My XXX Hot Girl
Van-der-Waals-Kräfte ( Van-der-Waals-Wechselwirkungen ), benannt nach dem niederländischen Physiker Johannes Diderik van der Waals, [1] sind die relativ schwachen nicht- kovalenten Wechselwirkungen zwischen Atomen oder Molekülen, deren Wechselwirkungs energie für kugelförmige Teilchen mit etwa der sechsten Potenz des Abstandes abfällt.

VanderWaalsKräfte · Entstehung & Beispiel · [mit Video]
Alkane mit 5 - 20 Kohlenstoffatomen sind Flüssigkeiten, also ab Pentan. Alkane mit mehr als 20 Kohlenstoffatomen sind Feststoffe. Alkanmoleküle sind unpolar, es gibt also keinen Ladungsschwerpunkt im Molekül. Deshalb wirken zwischen den Molekülen auch nur schwache Kräfte, die Van-der-Waals-Kräfte . Daher sind die Siede- und.
Van Der Waals Forces Equation
Die Van-der-Waals-Kräfte werden stärker!. Alkanole, Alkohole, Alkane, Alkanale, Alkansäuren, homologe Reihe, Siedetemperaturen, Löslichkeit.. Der Schwerpunkt liegt auf der Anwendung erworbener Kenntnisse bzgl. der zwischenmolekularen Wechselwirkungen zur Erklärung von Siedetemperaturen (und ggf. auch Löslichkeit)..
Van der Waals (London Dispersion) Forces The Credible Hulk
1) where A is the Hamaker coefficient , which is a constant (~10 −19 − 10 −20 J) that depends on the material properties (it can be positive or negative in sign depending on the intervening medium), and z is the center-to-center distance; i.e., the sum of R 1 , R 2 , and r (the distance between the surfaces): z = R 1 + R 2 + r {\displaystyle \ z=R_{1}+R_{2}+r} . The van der Waals force.

four different guitar heads are shown in this diagram
Physikalische Chemie. Mit den Van-der-Waals-Kräften ( Van-der-Waals-Wechselwirkungen ), benannt nach dem niederländischen Physiker Johannes Diderik van der Waals (1837-1923), [1] bezeichnet man die relativ schwachen nicht- kovalenten Wechselwirkungen zwischen Atomen oder Molekülen, deren Wechselwirkungs energie mit etwa der sechsten Potenz.

Kohlenwasserstoffe • Aliphatische, Aromatisch, Halogeniert · [mit Video]
Therefore, the boiling points of the alkanes increase with the molecular size. Regarding isomers, the more branched the chain, the lower the boiling point tends to be. Van der Waals dispersion forces are smaller for shorter molecules and only operate over very short distances between one molecule and its neighbors.

Alkohole • Nomenklatur, Homologe Reihe · [mit Video]
Die "Van-der-Waals-Wechselwirkungen im engeren Sinne" beschreiben die Verschiebung der Elektronen in unpolaren Molekülen. Diese sehr schwachen Wechselwirkungen können nur auf kurzer Distanz zwischen unmittelbar benachbarten Molekülen auftreten. Deshalb werden sie bei hohen Temperaturen durch die thermische Bewegung der Moleküle bereits.